
近日,化学与药学院高锦明教授团队在《Advanced Science》发表题为“Mechanistic Insights from the Crystal Structure and Computational Analysis of the Radical SAM Deaminase DesII”的研究论文,通过晶体学和计算化学的方法,阐释TDP-desosamine生物合成途径中的关键自由基SAM酶DesII的脱氨机制。
自由基SAM酶是一类利用铁硫簇与S-腺苷-L-甲硫氨酸催化自由基转化的金属酶,目前该酶家族已经有超过50万个成员,但只有一小部分被表征其功能活性。在已被解析的天然产物生物合成途径中,许多复杂的反应均依赖于自由基SAM酶的催化,这类酶通过四铁四硫簇还原SAM使其5'碳-硫键均裂,进而产生高度活泼的5'-脱氧腺苷自由基,该自由基可通过攫取底物上的氢原子生成底物自由基,从而引发烷基化、脱水、差向异构化或重排等多样的化学反应。
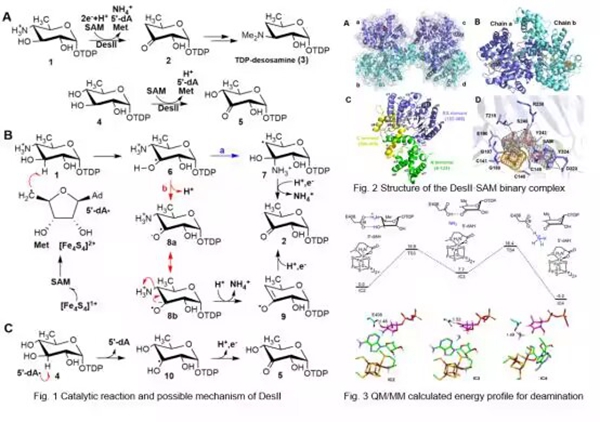
DesII是一种自由基S -腺苷-L-甲硫氨酸(SAM)裂解酶,通过生成C3底物自由基中间体催化TDP-4-amino-4,6-dideoxy-D-glucose的C4位发生脱氨反应生成TDP-4,6-dideoxy-3-keto-D-glucose(TDP="thymidine" diphosphate 胸苷二磷酸)。这步脱氨反应是 S. venezuelae 次生代谢产物TDP-desosamine生物合成中的关键步骤,而TDP-desosamine是红霉素、苦霉素和那波霉素等多种大环内酯类抗生素生物活性的重要组成元件。先前的研究表明,该反应是通过从α-羟烷基自由基或其共轭碱(即羰基自由基)中直接消除氨来进行的,而不是通过氨基的1,2-迁移来形成甲醇胺自由基中间体。然而,由于没有晶体结构,导致这种化学反应的活性位点的特征仍然未知。本文对DesII的晶体学进行研究,描述了DesII 活性位点的结构特征填补这一空白。基于结构的计算分析与直接消除一致,表明活性位点408位的谷氨酸残基可能作为促进α-羟烷基自由基中间体去质子化和氨基消除的碱。
实验和计算结果表明DesII通过直接消除催化脱氨反应,这与目前公认的EAL机制形成鲜明对比,并意味着自由基介导的裂解酶活性不必局限于单一的机制。DesII就是一个很好的例子,它可以通过简单地将一个离去基团换成另一个基团来转化为脱氢酶。因此,即使是底物或活性位点结构中的微小变动也可能导致新的化学反应,从而促进新的生物合成酶的进化。这可能有助于解释自由基SAM酶广泛的机制多样性和多功能性。
化学与药学院已毕业博士候雪丽和厦门大学的冯键强博士为论文的共同第一作者,高锦明教授和美国德克萨斯大学奥斯汀分校的Hung-wen Liu教授、南京师范大学的周佳海教授以及厦门大学的王斌举教授为共同通讯作者。
该研究工作受到了国家自然科学基金、国家重点研发计划 项目、深圳市科技项目和美国国立卫生研究院的支持。同时感谢上海同步辐射光源BL19U1线站工作人员在衍射数据收集方面提供的帮助。
论文链接https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202403494
编辑:张晴
终审:徐海

西北农林科技大学

西农深圳研究院
